Compare rec. lab reagents for research
Suppliers for Lab antibodies Our used antibodies in Pubmed.
Read MoreCompare Appoptosis lab reagents for research
Suppliers for Lab rec. Our used References in Pubmed.
Read More
Chemoprevention with a tea from hawthorn ( Crataegus oxyacantha) leaves and flowers attenuates colitis in rats by reducing inflammation and oxidative stress
The purpose of the study was to determine the effects of a tea from the leaves and flowers of Crataegus oxyacantha in rats with colitis. Colitis was induced by administration of 2,4,6-trinitrobenzene sulfonic acid. Hawthorn tea (HT) (100 mg/kg) was given via gavage for 21 days and the mesalamine drug (100 mg/kg) was administrated during the period…
Read More
Native α-Synuclein, 3-Nitrotyrosine Proteins, and Patterns of Nitro-α-Synuclein-Immunoreactive Inclusions in Saliva and Submandibulary Gland in Parkinson’s Disease
Background. Salivary α-synuclein (aSyn) and its nitrated form, or 3-nitrotyrosine-α-synuclein (3-NT-αSyn), hold promise as biomarkers for idiopathic Parkinson’s disease (IPD). Nitrative stress that is characterized by an excess of 3-nitrotyrosine proteins (3-NT-proteins) has been proposed as a pathogenic mechanism in IPD. The objective is to study the pathological role of native αSyn, 3-NT-αSyn, and 3-NT-proteins in the…
Read More
Senescence markers in focal nodular hyperplasia of the liver: pathogenic considerations on the basis of immunohistochemical results
Focal nodular hyperplasia (FNH) is a polyclonal tumour-like hepatic lesion characterised by parenchymal nodules, connective tissue septa without interlobular bile ducts, pronounced ductular reaction and inflammation. It may represent a response to local arterial hyperperfusion and hyperoxygenation resulting in oxidative stress. We aimed at obtaining closer insight into the pathogenesis of FNH with its characteristic…
Read More
Targeting CD99 compromises the oncogenic effects of the chimera EWS-FLI1 by inducing re-expression of zyxin and inhibition of Gli1 activity
Ewing sarcoma (EWS), a highly aggressive pediatric tumor, is driven by EWS-FLI1, an oncogenic transcription factor that remodels the tumor genetic landscape. Epigenetic mechanisms play a pivotal role in EWS pathogenesis, and the therapeutic value of compounds targeting epigenetic pathways is being identified in preclinical models. Here we showed that modulation of CD99, a cell…
Read More
PPARγ induces PD-L1 expression in MSS+ colorectal cancer cells
Only a small subset of colorectal cancer (CRC) patients benefits from immunotherapies, comprising blocking antibodies (Abs) against checkpoint receptor “programmed-cell-death-1” (PD1) and its ligand (PD-L1), because most cases lack the required mutational burden and neo-antigen load caused by microsatellite instability (MSI) and/or an inflamed, immune cell-infiltrated PD-L1+ tumor microenvironment. Peroxisome proliferator-activated-receptor-gamma (PPARγ), a metabolic transcription factor stimulated by…
Read More
A novel BRET based genetic coded biosensor for apoptosis detection at deep tissue level in live animal
ANNEXIN V belongs to a household of phospholipid binding proteins which is ready to bind to negatively charged phospholipids akin to phosphatidylserine (PS) within the presence of a excessive affinity Ca2+ ion. When apoptosis happens, even at early stage, PS shall be uncovered to the surface of the cell floor from the cytoplasm facet of membrane…
Read More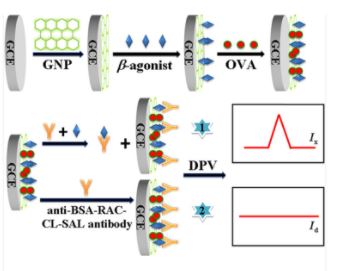
Nanometer-Sized Boron Loaded Liposomes Containing Fe 3 O 4 Magnetic Nanoparticles and Tributyl Borate and Anti-Albumin from Bovine Serum Antibody for Thermal Neutron Detection
A scarcity within the provide of 3He used for thermal neutron detector makes researchers to seek out 3He options for creating new neutron detectors. Right here, we ready a neutron-sensitive composite liposome with tributyl borate and encapsulating with Fe3O4@oleic acid nanoparticles (Fe3O4@OA NPs), methylene blue (MB), or anti-albumin from bovine serum (anti-BSA). The tributyl borate compound was…
Read More